|
|
受試者保護相關資訊(更新日期:2023/7/18)
|

|
|
|
- 人體試驗涉及受試者人權,如何兼顧受試者保護與醫藥研究發展,乃是研究倫理的重要課題;人體試驗審查會訪視計畫乃透過瞭解人體試驗審查會(Institutional Review Board, IRB)運作,保護受試者權益與安全。鑑於國際醫療科技發展競爭劇烈及研究成果深遠的影響,促進目前國內對人體試驗發展及研究倫理之相關研究、品質管理措施,建構我國良好研究環境,實為我國現階段重要課題。第一步除制訂「藥品優良臨床試驗規範(Good Clinical Practice, GCP)」、公告「醫療機構人體試驗審查會組織及作業基準」、「人體研究倫理政策指引」、「人體試驗管理辦法」及相關規範外,衛生福利部和醫策會合作導入人體試驗審查會訪視制度。
- 本會藉由2005年、2007年至2010年之訪視及輔導經驗,持續協助我國人體試驗審查會提升運作品質及改善經營管理,由訪視結果已見長足進步,並有1%受訪審查會及訪視委員認同訪視計畫是重要、有益且影響深遠的;另外,亦期待能發展更適合我國之訪視基準,並融入「保障受試者權益與安全」精神,全力投入試驗品質確保工作,進一步提升我國生醫研究環境。
- 為使民眾及相關研究人員瞭解倫理審查委員會(Institutional Review Board, IRB)設立之目的及審查流程,本會特製作兩款懶人包供各界參考如下:
- 民眾版:研究倫理的守護者,以淺顯易懂的方式說明IRB設立之目的、審查內容及職責。
- 研究人員版:IRB申請及審查攻略,將IRB申請及審查流程依序呈現,並提醒研究人員需注意之重要事項。
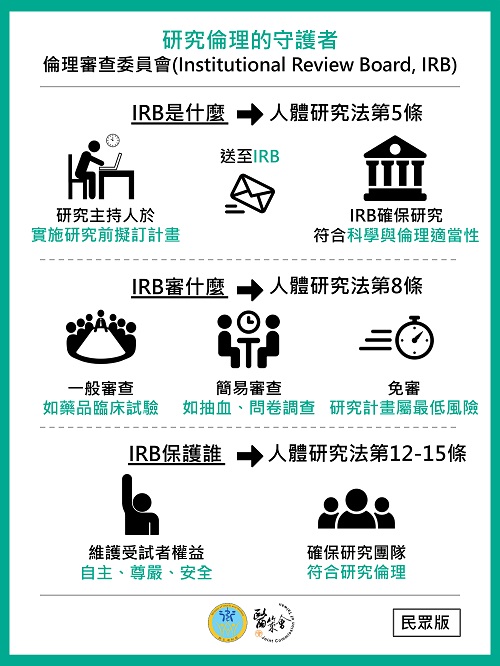
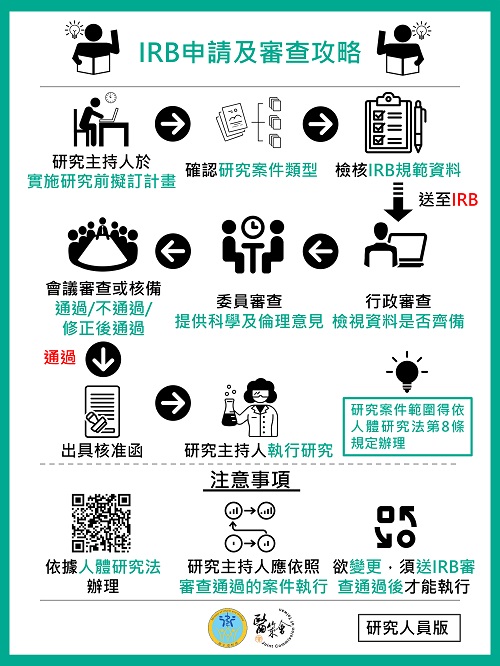
(資料來源:財團法人醫院評鑑暨醫療品質策進會)
|
|
|
|
 |
| |
| 25 | 26 | 27 | 28 | 29 | 30 | 31 | | 1 | 2 | 3 | 4 | 5 | 6 | 7 | | 8 | 9 | 10 | 11 | 12 | 13 | 14 | | 15 | 16 | 17 | 18 | 19 | 20 | 21 | | 22 | 23 | 24 | 25 | 26 | 27 | 28 | | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|
|
|
|
|