Page 21 - 分子轉譯影像中心季刊X
P. 21
文/邱涵
隨著醫學進步發展,人類生命延長許多,但社會老化同時也伴隨增加許多醫
療問題,像是與年齡相關的神經退化疾病。大部分神經退化疾病在病裡學上發現
與超過一種以上的蛋白質沉澱堆疊相關。Alzheimer disease (AD),阿茲海默症
是高齡社會主要的老年神經疾病,因此發展有效的診斷與治療方法是非常重要的。
此疾病的兩大神經病理標誌即為(1)細胞外amyloid-β(Αβ)類澱粉蛋白沉積與(2)細
胞內tau神經纖維糾結(neurofibrillary tangles ; NFTs)堆疊。
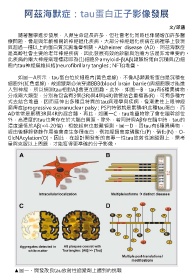
如圖一A所示,tau蛋白位於細胞內(黃色虛線),不像Αβ類澱粉蛋白是沉積在
細胞外(紅色虛線),故追蹤劑必須穿過BBB(blood brain barrier)與細胞膜才能進
入到神經,所以偵測tau相對Αβ會更加困難。此外,如圖一B,tau有6種異構物,
分成兩大類型,分別為包含有3個(3R)與4個(4R)微管結合重複區(R),可有多種方
式去結合堆疊,因而延伸出多種且特異的tau病理學與疾病,像漸進性上眼神經
麻痺症(progressive supranuclear palsy ; PSP)特徵就是累積4R此種tau蛋白,而
AD常常是累積3R與4R的混合體。再此,如圖一C,tau堆疊物除了會在腦幹部位
外,高濃度的tau也會存在於大腦白質區。除外,若同時與Αβ存在腦中時,tau的
濃度遠低於Αβ(<4-20倍),相較起來也較難偵測。圖一D,因tau有6種異構物,
經由後轉錄修飾作用後會產生多種蛋白,例如經過高度磷酸化(P)、硝化(N)、O-
GlcNAcylation(O)。因此,在設計開發新的高專一性tau放射性追蹤劑上,需考
量與克服以上問題,才能獲得更準確的分子影像。
▲圖一、開發改良tau放射性追蹤劑上遇到的挑戰