預防的效果
針對符合計劃書之預防效果分析條件(per-protocol
efficacy; PPE)的受試對象進行主要預防效果分析,亦即在進入研究後1年內完整接種3劑疫苗、未明顯偏離研究計劃規定事項、並且在接種第1劑前至接種第3劑後1個月(第7個月)期間皆未感染相關HPV型別的受試者。自第7個月的回診之後開始進行預防效果評估(表1)。表1
(表1)預防的效果
針對符合計劃書之預防效果分析條件(per-protocol efficacy; PPE)的受試對象進行主要預防效果分析,亦即在進入研究後1年內完整接種3劑疫苗、未明顯偏離研究計劃規定事項、並且在接種第1劑前至接種第3劑後1個月(第7個月)期間皆未感染相關HPV型別的受試者。自第7個月的回診之後開始進行預防效果評估。
PPE受試對象中的GARDASIL預防效果分析
|
受試對象 |
GARDASIL |
安慰劑 |
預防效果% (95% CI) |
|
n |
病例數 |
n |
病例數 |
|
由HPV
16或18型所引起的CIN
2/3或AIS |
|
計劃書005* |
755 |
0 |
750 |
12 |
100.0 (65.1, 100.0) |
|
計劃書007 |
231 |
0 |
230 |
1 |
100.0 (<0.0, 100.0) |
|
FUTURE I |
2,200 |
0 |
2,222 |
19 |
100.0 (78.5, 100.0) |
|
FUTURE II |
5,301 |
0 |
5,258 |
21 |
100.0** (80.9, 100.0) |
|
綜合計劃書 |
8,487 |
0 |
8,460 |
53 |
100.0** (92.9, 100.0) |
|
由HPV
6、11、16、18型所引起的CIN
(CIN 1、CIN
2/3)或AIS |
|
計劃書007 |
235 |
0 |
233 |
3 |
100.0 (<0.0, 100.0) |
|
FUTURE I |
2,240 |
0 |
2,258 |
37 |
100.0** (89.5, 100.0) |
|
FUTURE II |
5,383 |
4 |
5,370 |
43 |
90.7 (74.4, 97.6) |
|
綜合計劃書 |
7,858 |
4 |
7,861 |
83 |
95.2 (87.2, 98.7) |
|
由HPV
6、11、16或18型所引起的生殖器病變(生殖器疣、CIN
1、VaIN) |
|
計劃書007 |
235 |
0 |
233 |
3 |
100.0 (<0.0, 100.0) |
|
FUTURE I |
2,261 |
0 |
2,279 |
40 |
100.0** (90.3, 100.0) |
|
FUTURE II |
5,401 |
1 |
5,387 |
70 |
98.6 (91.8, 100.0) |
|
綜合計劃書 |
7,897 |
1 |
7,899 |
113 |
99.1 (95.0, 100.0) |
|
*僅針對GARDASIL中的HPV
16 L1 VLP疫苗成分進行評估。
**依據預先指定的主要假說試驗計算p值。所有的p值皆<0.001,佐證下列結論:對HPV
16/18所引起之CIN
2/3的預防效果為>0%
(FUTURE II);對HPV
16/18所引起之CIN
2/3的預防效果為>25%
(綜合計劃書);對HPV
6/11/16/18所引起之CIN的預防效果為>20%
(FUTURE I)
;以及對HPV
6/11/16/18所引起之外陰病灶的預防效果為>20%(FUTURE
I)。
n=第7個月後回診追蹤至少1次以上的受試人數。.
註:時間點估計值與信賴區間已依個人追蹤時間進行校正。 |
GARDASIL對抗疫苗所含之4種HPV型別中每一種型別所引起的人類乳突病毒疾病,都有同樣的效果。預防效果的證據來至於疫苗接種期間的觀察,對於接種疫苗之前未曾感染過相關的HPV型別的婦女,GARDASIL對在疫苗接種期間因感染HPV
6、11、16及18所引起之CIN
(任何等級)的預防效果為91%,因感染HPV
16或18所引起的CIN
2或更為嚴重之病變的預防效果則為95%。
在一個附加的分析中,GARDASIL對抗第16、18型人類乳突病毒相關之疾病的預防效果,對FIGO第0期子宮頸癌(CIN
3或AIS)為100%(95%
CI︰87.9%,100.0%),對VIN
2/3或VaIN
2/3為100%(95%
CI︰55.5%,100.0%)。
對加入試驗時或之前曾經發生HPV感染之受試者的預防效果
對於在接種疫苗前已感染1種(含)以上之疫苗相關HPV型別的人,仍可預防感染其它疫苗HPV型別所引起的臨床病變。
對於加入試驗時就已經有早期感染HPV的人,接種GARDASIL對於CIN或AIS發生率的降低,與安慰劑相比並沒有顯著的差異。疫苗的預防效果估計為27%
(95%
CI︰<0.0%,47.0%)。早期感染被定義為,在加入試驗時就已經感染疫苗所含之人類乳突病毒型別,但未對其產生免疫反應。
對一般大眾的影響
GARDASIL並不能預防疫苗中未含有之HPV型別所引起的疾病。
一項期中分析以評估GARDASIL對受試者在加入試驗之後,因感染不論是否為疫苗所含型別之HPV而引發CIN
2/3或AIS的影響。在第II期與第III期預防效果研究中,並未包含篩檢期,因此,試驗受試者亦包含在加入試驗時已感染不論是否為疫苗所含型別之HPV。
為著眼於GARDASIL對受試者在加入試驗之後,因感染而引發CIN
2/3或AIS病例的影響,針對加入試驗第一天時未感染任何疫苗所含之四種型別且抹片檢查結果呈陰性的受試者進行分析。自接種第一劑30天後發生的病例開始計算,這樣的分析條件,可移除大半(不是完全移除)在加入試驗時已感染而導致的CIN
2/3及AIS的病例。這些號稱未曾感染HPV受試者的分析結果如表2所示,接種GARDASIL可降低新感染進而降低CIN
2/3的發生率。與安慰劑比較,接種GARDASIL組的影響程度隨觀察時間的增長而加大。GARDASIL組與安慰劑組均有觀察到因感染非疫苗所含型別而引發的病例數。
表2
對於號稱未曾感染HPV的族群中,GARDASIL對因新感染不論是否為疫苗所含型別而引發CIN
2/3 or AIS病例的影響
|
終點指標 |
GARDASIL
(N=9,075) |
安慰劑
(N=9,075) |
影響程度%
|
95% CI |
|
n |
病例數 |
n |
病例數 |
|
CIN 2/3 or AIS |
5,638 |
59 |
5,701 |
96 |
37.9 |
(13.2, 55.9) |
|
CIN 2 |
5,638 |
42 |
5,701 |
74 |
42.6 |
(15.1, 61.7) |
|
CIN 3 or AIS |
5,638 |
28 |
5,701 |
52 |
45.5 |
(12.2, 66.9) |
|
發生病例列入適當的終點指標中計算,一個病例可列入一個以上的終點指標。.
N =
經隨機分配至各疫苗接種組且接種1劑以上的人數。
n =
評估的人數,即回診追蹤至少1次以上的人數。.
CI =
信賴區間;
CIN =
子宮頸上皮內贅瘤。 |
對抹片檢查結果異常及HPV相關疾病之治療程序的總體影響
就一群包含感染過以及未曾感染HPV的年輕婦女,經過兩年的追蹤結果,施打GARDASIL降低了10%經抹片檢查出CIN
1或更嚴重的發生率。
GARDASIL可使診斷為CIN2/3或慢性CIN
1所需的確定性治療(如迴路電外科切除術)的施行率降低16.5%,並使治療生殖器疣的確定性治療手術減少26.5%。
由於GARDASIL並未證實可預防所有HPV類型所引起的病變,也無法治療由疫苗中含有之HPV型別所引起的既有疾病,所以GARDASIL的整體預防效果將取決於HPV感染的基礎盛行率,以及接種疫苗族群產生的病變。
免疫生成性
曾針對12,315位受試者(GARDASIL組N=7,208;安慰劑組N=5,107)評估GARDASIL的免疫生成性。因為在臨床試驗中GARDASIL的預防效果非常高,因此一直無法確立可預防HPV所引起之臨床病變的抗HPV
6抗體、抗HPV
11抗體、抗HPV
16抗體及抗HPV
18抗體的最低濃度。
研究人員係採用具型別專一標準品來評估各疫苗HPV型別的免疫生成性。這些分析法可針對個別HPV型別檢測體內所生成的可對抗中和性表位的抗體,而非檢測對所有疫苗型別VLPs所產生的抗體總和。由於這些分析法對各HPV型別具專一性,因此並不適合進行跨型別的比較,或是和其它分析法所得結果進行比較。這些用來測量對GARDASIL免疫反應的分析,證實與中和人類乳突病毒活病毒體的能力有關聯性。
針對符合計劃書之免疫生成性分析條件(per-protocol
immunogenicity; PPI)的受試對象進行基礎免疫生成性分析。這些受試對象係指進入研究時之相關HPV型別檢測呈血清陰性反應及聚合酶連鎖反應(Polymerase
Chain Reaction; PCR)陰性反應、相關HPV型別的檢測結果直到接種第3劑後1個月(第7個月)仍維持HPV
PCR陰性、完整接種3劑疫苗、並且未偏離研究計劃規定事項至可能影響疫苗效果之程度的受試者。
接種第三劑疫苗後一個月,在所有受試者的年齡層,GARDASIL皆可誘發出高於加入試驗前曾感染的婦女所檢測的抗人類乳突病毒幾何平均抗體效價(Geometric
Mean Titers; GMTs)。整體而言,在接種三劑疫苗後一個月時,所有接種GARDASIL的人不論年齡,分別有99.8%、99.8%、99.8%和99.5%的人對第6、11、16和18型人類乳突病毒呈血清抗體陽性反應。由疫苗誘發的人類乳突病毒抗體值,比那些加入試驗之前已感染並誘發免疫反應而消除感染的婦女中所測到的值高出很多。
一項在疫苗接種療程中,測量對接種三劑GARDASIL療程中的免疫反應所作的研究顯示,接種二劑疫苗後抗人類乳突病毒抗體值,比那些第三期研究中長期追蹤期間觀察到的更高。整體而言,在接種二劑疫苗後一個月,有97.6到100%對第6、11、16和18型人類乳突病毒呈血清陽性反應。這些結果支持所觀察到的,在三劑量疫苗接種療程期間,GARDASIL已產生保護效果。
青、少年的的免疫生成性
一項比較10到15歲男孩和女孩與16到23歲青少年和年輕女性,在抗第6、11、16和18型人類乳突病毒反應的臨床研究。在接種GARDASIL的受試者中,接種第三劑疫苗後一個月時,分別有99.5到100%對第6、11、16和18型人類乳突病毒呈血清陽性反應。在10到15歲女孩和男孩的抗人類乳突病毒反應,明顯優於那些在16到23歲所觀察到的。
一項比較9到15歲的女孩與16到26歲的青少年和年輕女性,接種三劑疫苗後一個月所觀察到的抗人類乳突病毒反應,從GARDASIL免疫生成性研究的綜合數據顯示具有相似的結果。
根據這種免疫生成性的銜接性,9到15歲的女孩與16到26歲的青少年和年輕女性,在第三期研究中所觀察到的GARDASIL預防效果類似。
抗體再生(免疫的記憶)反應的證據
GARDASIL會增強已有免疫反應的人(即顯示曾自然感染的人)。對於每一種人類乳突病毒型別來說,在加入試驗第一天可偵測到該種抗體的人,接種三劑疫苗後一個月所測量到的抗人類乳突病毒的GMTs,會比第一天那種型別呈血清陰性的受試者高出二倍以上。
GARDASIL誘發疫苗所含的人類乳突病毒型別的免疫反應不會受到干擾。疫苗所含人類乳突病毒型別的其中一種型別在加入第一天時呈血清陽性,並不會在接種三劑疫苗後對其他型別的抗人類乳突病毒反應有負面影響。
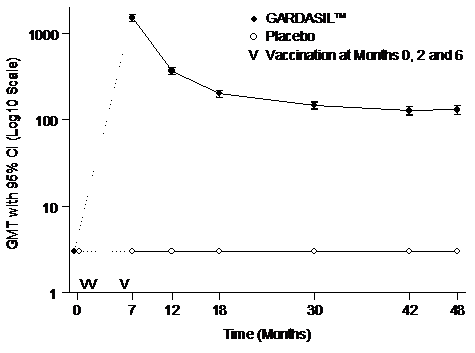
持續性
一項評估GARDASIL第16型人類乳突病毒於16到23歲婦女的研究顯示,抗第16型人類乳突病毒的GMTs在第7個月會大量上升。GMTs會逐漸下降,直到第24個月後趨於穩定但仍高於自然感染所產生的GMTs
(參見圖一)。
圖一
長期追蹤之抗第16型人類乳突病毒的抗體反應

一項評估GARDASIL於16到23歲婦女的研究顯示,抗第6型、抗第11型、抗第16型和抗第18型人類乳突病毒的GMTs,在第7個月會大量上升。GMTs會逐漸下降,直到第24個月後趨於穩定但仍高於自然感染所產生的GMTs
(例如抗第18型人類乳突病毒的抗體反應--參見圖二)。
圖二
長期追蹤之抗第18型人類乳突病毒的抗體反應

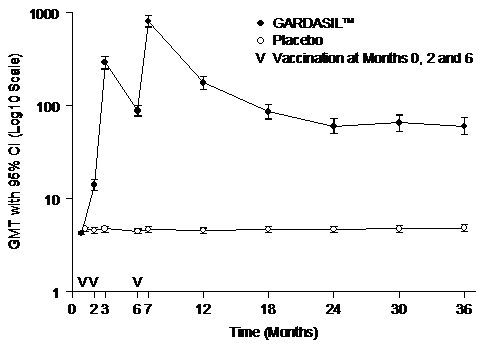
時間表彈性度
所有在第二期和第三期研究的符合計劃書執行的預防效果族群中評估之受試者,不管劑量之間的間隔如何,但都在1年內完成GARDASIL的三劑接種。一項免疫反應的數據分析顯示,第二劑量有前後1個月的彈性(即在接種第一劑之後的第一個月到第三個月間接種),而第三劑量有前後2個月的彈性(即在接種第一劑之後的第四個月到第八個月接種),這對GARDASIL的免疫反應並不會有很大的影響(參見用法用量)。
GARDASIL與基因重組B型肝炎疫苗併用(同一次回診,在分開的部位注射)的安全性和免疫生成性,在一項針對1,869位加入試驗時為16到24歲婦女所作的隨機分配研究中被評估。無論是於同次看診時施打或於不同次看診時分開施打,對基因重組B型肝炎疫苗和GARDASIL兩者的免疫反應和安全性相似。
適應症
預防疫苗所含的人類乳突病毒型別所引起的癌症、癌前期或分化不良的病變、生殖器疣以及感染。
說明
GARDASIL疫苗,適用於9到26歲*的婦女以預防疫苗所含的人類乳突病毒第6,
11, 16,及18型引起的癌子宮頸癌、外陰癌和陰道癌、癌前期或分化不良的病變、生殖器疣以及感染。
GARDASIL疫苗,適用於9到15歲的男性以預防疫苗所含的人類乳突病毒第6,
11, 16,及18型引起的感染。
*已執行免疫生成性試驗
禁忌症
對本疫苗之活性成分或任何賦形劑過敏者。
曾於接種一劑GARDASIL後出現過敏症狀者,不可再接種後續劑次的GARDASIL。
注意事項
一般
和任何疫苗一樣,接種GARDASIL疫苗可能無法對所有的疫苗接種者都產生保護作用。
本疫苗並不適用於治療不論是否由疫苗所含的HPV血清型所引發的活動性生殖器疣、子宮頸癌、、外陰癌或陰道癌;CIN、VIN或VaIN。
本疫苗並無法預防非由人類乳突病毒(HPV)所引起的病變。
GARDASIL不能預防非由HPV所引起的病變,本疫苗並未證實可預防非疫苗所含型別所引起的病變,因此,接種疫苗者仍須定期接受子宮頸癌篩檢,以便偵測並移除子宮頸病變。
和所有的注射用疫苗一樣,應隨時備妥適當的醫療措施,以防施打疫苗後發生罕見的過敏性反應。
因最近或正發生發燒性疾病而須做出進行或延遲疫苗接種的決定時,主要的取決依據為症狀的嚴重程度及其病因。輕度發燒本身和輕微的上呼吸道感染通常並非接種疫苗的禁忌症。
免疫反應性因接受免疫抑制治療、基因缺陷、感染人類免疫不全病毒(HIV)或其它原因而出現減弱現象者,接受主動性免疫接種後所產生的抗體反應可能會降低(參見藥物交互作用)。
為患有血友病或任何有凝血問題疾病的患者施打本疫苗時須謹慎小心,因這些病患在肌肉注射劑之後,可能會出血不止。
致癌性
目前尚未評估過GARDASIL引發致癌性的可能性。
致突變性
目前尚未評估過GARDASIL引發基因毒性的可能性。
生育力的影響
對母鼠分別在懷孕早期及產後一週分兩次各以肌肉注射施打一劑500微升的GARDASIL,或於交配的五週前及兩週前、懷孕早期及產後一週分四次施打,結果對交配能力、生育力、或其子代都沒有影響。目前尚未研究過GARDASIL對雄性生育力的影響。
懷孕婦女之使用(妊娠分級:B)
對母鼠分別在懷孕早期及產後一週分兩次各以肌肉注射施打一劑500微升的GARDASIL,或於交配的五週前及兩週前、懷孕早期及產後一週分四次施打,均未觀察到妊娠毒性或造成子代的不良反應。自懷孕期間母體血液中、近足月的胎兒血液中、子代斷奶期及出生後11周的血液中均可偵測到高濃度的各專一HPV抗體,即代表這些抗體可透過胎盤及母乳傳給子代(參見授乳婦女之使用)。目前尚未研究過雄性接種GARDASIL對其子代的影響。
臨床研究進行中,在接種每一劑GARDASIL之前,婦女都須先接受尿液驗孕測試。在完成三劑GARDASIL接種之前發現懷孕的婦女,被指示延遲完成她們的疫苗接種,直到懷孕狀態解除。這樣非標準化的療程在接種三劑疫苗後,所造成的對第6、11、16和18型人類乳突病毒的抗體反應,與接受標準0、2和6個月疫苗接種時程的婦女中所觀察到的類似(參見用量用法)。
臨床試驗期間,有2,266位婦女(疫苗組1,115位與安慰劑組1,151位)曾懷孕一次以上。整體而言,具不良結果的懷孕比例,在接種GARDASIL與接受安慰劑的受試者中相當。
執行進一步的分析來評估使用GARDASIL或安慰劑一個劑量後,在30天內或超過30天發生的懷孕。對於疫苗接種30天內發生懷孕者,在接種GARDASIL的哪一組中,有5例先天性異常被觀察到,相較起來,在接受安慰劑的哪一組中,則無先天性畸形被觀察到。相反地,對於疫苗接種後超過30天才懷孕者,在接種GARDASIL的哪一組中,有10例先天性異常被觀察到,相較起來,在接受安慰劑的哪一組中,則有16例先天性異常被觀察到。觀察到的異常類別(不管懷孕發生在疫苗接種的什麼時候),和一般16到26歲婦女懷孕過程中所觀察到的一致。
因此,沒有證據顯示使用GARDASIL對生殖、懷孕或嬰兒具有不良的影響。
授乳婦女之使用
對母鼠分別在懷孕早期及產後一週分兩次各以肌肉注射施打一劑500微升的GARDASIL,或於交配的五週前及兩週前、懷孕早期及產後一週分四次施打,均未觀察到妊娠毒性或造成子代的不良反應。接種兩劑的母鼠所生的子代在斷奶期比近足月的胎兒期有較高濃度的各專一HPV血清值,表示抗體可透過乳汁及胎盤移轉(參見懷孕婦女之使用)。試驗中,在出生後第11週做最後一次檢測時,子代體內仍存有抗體
未知疫苗引起的疫苗抗原或抗體是否會排泄在人類乳汁中,對授乳婦女施打GARDASIL時應謹慎。
在臨床試驗中接種疫苗期間,總共有995位授乳母親接種GARDASIL或安慰劑。在這些研究中,母親和哺乳嬰兒的不良經驗比率,在接種疫苗的組別之間類似。此外,在疫苗使用期間,授乳母親和沒有授乳的婦女,其疫苗的免疫生成性類似。
小兒之使用
目前尚未評估過GARDASIL在9歲以下之兒童中的安全性與預防效果。
較大成年人之使用
目前尚未評估過GARDASIL在較大成年人中的安全性與預防效果。
其他特殊族群之使用
GARDASIL的安全性、免疫生成性和預防效果尚未在感染人類免疫缺乏病毒的人作評估。
藥物交互作用
與其他疫苗併用
臨床研究的結果顯示,GARDASIL可以與基因重組B型肝炎疫苗併用(在不同部位一個分開的注射部位)。
與一般藥物併用
在臨床研究中,有11.9%、9.5%、6.9%和4.3%的人分別使用止痛藥、消炎藥、抗生素和維生素製劑。疫苗的預防效果、免疫生成性和和安全性並沒有因為使用這些藥物而受影響。
與荷爾蒙避孕藥併用
在臨床研究中,接種GARDASIL的婦女(16到26歲)中,有57.5%使用荷爾蒙避孕藥。使用荷爾蒙避孕藥並未對GARDASIL的免疫反應有影響。
與類固醇併用
在臨床研究中,有1.7%(n
= 158)、0.6%(n
= 56)和1.0%(n
= 89)的人,在距離接種任一劑GARDASIL不久時,分別使用吸入的、局部的和非口服的免疫抑制劑。這些藥物未對GARDASIL的免疫反應造成影響。在臨床研究中,極少受試者使用類固醇,而且免疫抑制程度有限。
與全身性免疫抑制藥物併用
目前沒有強效免疫抑制劑與GARDASIL併用的資料。接受免疫抑制劑(全身性劑量的類固醇、抗代謝藥物、烷化製劑、細胞抑制劑)治療的人,可能對主動性預防接種無法有理想的反應(參見注意事項,一般)。
不良反應
在5個臨床試驗(4個為安慰劑對照)中,受試者在加入試驗的那一天與其後大約2
和6個月給予GARDASIL或安慰劑。當與安慰劑(含鋁或未含鋁)相較時,GARDASIL被證實有較好的安全特性。少數受試者(0.2%)由於不良經驗而中斷試驗。所有臨床試驗除了一個之外,每次注射GARDASIL或安慰劑之後,都有使用疫苗接種紀錄卡(VRC)協助監視14天來評估安全性。使用VRC協助監視來監控的受試者,包含了接受GARDASIL的6,160位受試者(加入試驗時有5,088位9到26歲的女性以及1,071個9到15歲的男性)和接受安慰劑的4,064位受試者。
常見的不良經驗
與疫苗相關的常見不良經驗
在GARDASIL接種者中之出現頻率至少為1.0%且高於安慰劑接種者的疫苗相關不良經驗如表3所示。
|
表3
與疫苗相關的注射部位不良經驗及全身性不良經驗* |
|
不良經驗
(疫苗接種後1
至
5
天) |
GARDASIL
(N =
6,160)% |
含鋁安慰劑
(N =
3,470)% |
生理食鹽水安慰劑
(N = 594)% |
|
注射部位
痛
腫
紅
出血
癢 |
81.3
24.2
23.6
3.2
2.7 |
75.4
15.8
18.4
3.9
2.8 |
45.4
7.7
13.2
2.6
0.9 |
|
不良經驗
(疫苗接種後1
至
5
天) |
GARDASIL
(N =
6,160)% |
安慰劑
(N =
4,064)% |
|
全身性
發燒 |
10.1 |
8.4 |
|
*
在GARDASIL接種者中之出現頻率至少為1.0%且高於安慰劑接種者的疫苗相關不良經驗。 |
涵蓋所有導因的常見全身性不良經驗
在受試者中之出現頻率高於或等於1.0%,且疫苗接種組中之發生率高於或等於安慰劑組的所有導因全身性不良經驗如表4所示。
|
表4
涵蓋所有導因的常見全身性不良經驗 |
|
不良經驗
(接種疫苗後1至15天) |
GARDASIL
(n = 6160)
% |
安慰劑*
(n = 4064)
% |
|
發燒 |
12.9 |
11.0 |
|
腹瀉 |
3.7 |
3.6 |
|
嘔吐 |
2.4 |
2.1 |
|
肌痛 |
2.0 |
2.0 |
|
咳嗽 |
1.9 |
1.6 |
|
牙痛 |
1.3 |
1.3 |
|
上呼吸道感染 |
1.5 |
1.5 |
|
不適 |
1.2 |
1.2 |
|
關節痛 |
1.2 |
1.0 |
|
失眠 |
1.0 |
0.9 |
|
鼻充血 |
1.1 |
1.0 |
|
*含鋁及/或不含鋁的安慰劑 |
各劑次發燒反應評估
受試者接種各劑次後之發燒反應所進行的分析如表6所示。
|
表6
接種各劑次後之發燒反應的評估 |
|
|
疫苗
(發生率%) |
安慰劑
(發生率%) |
|
體溫
(°F) |
接種
第1劑後 |
接種
第2劑後 |
接種
第3劑後 |
接種
第1劑後 |
接種
第2劑後 |
接種
第3劑後 |
|
³100至<102 |
3.7 |
3.9 |
4.2 |
3.0 |
3.7 |
3.5 |
|
³102 |
0.4 |
0.5 |
0.6 |
0.3 |
0.4 |
0.6 |
嚴重不良經驗
GARDASIL臨床試驗期間,在GARDASIL組與安慰劑組合計21,464名的受試者中(包括9至26歲的女孩和女性,以及9至15歲的男孩),共有102名受試者通報於任一次疫苗接種門診後1-15天期間發生嚴重的不良經驗。在GARDASIL組與安慰劑組中,最常通報(不考慮導因)的嚴重不良事件為:
頭痛
(GARDASIL組0.03%,安慰劑組0.02%)
腸胃炎
(GARDASIL組0.03%,安慰劑組0.01%)
盲腸炎
(GARDASIL組0.02%,安慰劑組0.01%)
骨盆發炎疾病
(GARDASIL組0.02%,安慰劑組0.01%)
有1個支氣管痙攣通報病例及2個氣喘通報病例被認定為任一次疫苗接種門診後1-15天期間所發生的嚴重不良經驗。
死亡
在21,464名參與各項臨床研究的男性和女性受試者中,共有17個死亡病例。這些通報事件和健康青少年及成年人口中的預期事件大致相當。最為常見的死亡導因依次為交通意外(GARDASIL接種組中有4例,安慰劑組中有3例)、用藥過量/自殺(GARDASIL接種組中有1例,安慰劑組中有2例)、以及肺栓塞/深部靜脈血栓(GARDASIL接種組中有1例,安慰劑組中有1例)。此外,在GARDASIL接種組中另有2個敗血症病例、1個胰臟癌病例、以及1個心律不整病例,在安慰劑組中則另有1個窒息病例。
全身性自體免疫疾病
在臨床研究中,研究人員曾針對受試者於長達4年之追蹤期間所發生的新症狀進行評估。GARDASIL接種組與安慰劑組中發生可能意味全身性免疫疾病之新症狀的的受試人數如表7所示。
|
表7
加入GARDASIL臨床試驗後
通報發生一項可能意味全身性免疫疾病之伴隨症狀的受試者摘要 |
|
可能的自體免疫疾病 |
GARDASIL
(N=11,813) |
安慰劑
(N=9,701) |
|
特有病名 |
3
(0.025%) |
1
(0.010%) |
|
幼年型關節炎 |
1 |
0 |
|
類風濕性關節炎 |
2 |
0 |
|
全身性紅斑性狼瘡 |
0 |
1 |
|
其它病名 |
6
(0.051%) |
2
(0.021%) |
|
關節炎 |
5 |
2 |
|
反應性關節炎 |
1 |
0 |
|
N=研究所收錄的受試人數 |
與其它疫苗併用的安全性
有一項安慰劑對照研究曾針對GARDASIL與基因重組B型肝炎疫苗同時施打時的安全性進行評估。在同時接種兩種疫苗的受試者中,全身性不良經驗或注射部位不良經驗的發生率在統計學上皆未明顯高於單獨施打GARDASIL或B型肝炎疫苗的受試者。
過量
曾有使用比GARDASIL建議劑量高的案例被通報。
一般而言,因過量使用所通報的不良事件特性,與使用GARDASIL建議劑量發生的類似。
用法用量
GARDASIL建議用在9到15歲的孩童和青少年,以及16到26歲的婦女(參見適應症)。
用量
GARDASIL應依下列時間表以肌肉注射的方式分別施打3劑每劑0.5毫升的劑量︰
第一劑︰一個選定的日期。
第二劑︰第一劑的2個月後。
第三劑︰第一劑的6個月後。
建議應遵守0、2和6個月的疫苗接種時程。不過,臨床研究結果顯示,在1年內完成全部三劑接種的人具有保護效力。如果必須修改疫苗接種時間表,第二劑量必須距接種首劑後1個月以上才能施打,而第三劑必須在第二劑施打至少3個月之後才能使用(見臨床研究、時間表彈性度)。
用法
GARDASIL應該在上臂的三角肌區域,或是在大腿較高的前外側區域給予肌內注射。
GARDASIL不可注入血管內。皮下和皮內使用尚未經研究,因此不建議。
預充於針筒的疫苗僅供單次使用,而且不應該使用於一人以上。對單次使用的小瓶來說,每一個人必須單獨使用一套無菌的注射器和針頭。
疫苗請以原包裝使用;不要稀釋或重新調配。請遵照疫苗的建議劑量使用。
在使用之前充分搖勻
在使用之前必須徹底搖勻,以保持疫苗的懸浮性。
在徹底搖動之後,GARDASIL是白色、混濁的液體。注射用的藥品,在使用之前應該目測檢查是否含顆粒物質或變色。如果該產品有顆粒存在或變色,請勿使用並將其丟棄。
預充疫苗針筒的使用
將針筒中的全部內容物注入體內。
單劑裝小瓶的使用
使用一套不含防腐劑、殺菌劑和清潔劑的無菌針頭與針筒,從單劑裝小瓶中抽出0.5毫升劑量的疫苗。單劑裝小瓶一經刺穿之後,抽出的疫苗應立即使用,而小瓶則必須丟棄。
包裝
0.5 ml Vial,單一劑量包裝:1支裝及10支裝
0.5 ml Syringe,單一劑量包裝:1支裝及10支裝,每劑另附1吋長之25號針及1吋長之23號針各一支於盒內。
貯存
冷藏在2到8℃(36到46℉)、不可冷凍、避光儲存。
GARDASIL若自冷藏狀態中拿出,應儘早使用。若自冷藏狀態移出,在25°C或以下之室溫,則可保存至三天
製造廠:美國默克藥廠Merck
& Co., Inc.
廠
址:West
Point, PA, USA
針筒裝包裝廠:荷蘭默沙東藥廠MERCK
SHARP & DOHME B.V.
廠
址:Waarderweg
39, 2031 BN Haarlem, The Netherlands.
小瓶裝包裝廠:澳洲默沙東藥廠MERCK
SHARP & DOHME (Australia) Pty. Limited
廠
址:54-68
Ferndell Street, South Granville, N.S.W. 2142 Australia
藥
商:美商默沙東藥廠股份有限公司台灣分公司
地
址:台北市敦化南路二段216號14樓







